2025年6月4日,首都师范大学生命科学学院侯聪聪/李乐攻团队与美国加州大学伯克利分校Sheng Luan教授开展国际合作非常谋略,在Molecular Plant上发表题为“Activation of the CNGC2-CNGC4 channel complex by P2K1-mediated phosphorylation links extracellular ATP perception to calcium signaling in plant immunity”的研究论文。该研究首次揭示了连接胞外ATP(eATP)感知与胞内钙信号产生及下游免疫应答的关键分子事件,尤其是发现了编码这一独特钙信号的编码器(受体与通道复合体)及其工作模式,从而解决了eATP信号转导调控植物免疫的长期未解之谜。

生物细胞在遭受病原体侵袭或机械损伤时,胞内ATP会释放至细胞外,作为“损伤相关分子模式”(DAMP)激活免疫反应。此前研究已鉴定出植物P2K1/DORN1是胞外ATP(eATP)的可能受体,其在eATP介导的免疫信号传导中发挥重要功能,观察到在p2k1突变体中,ATP诱导的细胞内瞬时钙响应显著减弱。因为P2K1作为激酶,本身不能介导钙离子的跨膜流动,因此,参与这一过程的钙离子通道长期未被发现,P2K1 如何将胞外eATP刺激转化为胞内特异的钙信号,该现象背后的分子机制长期悬而未决。
研究显示,拟南芥中环腺苷酸门控通道2和4双突变体(cngc2cngc4)表现出eATP诱导的胞质钙升高、ATP应答相关基因转录及促分裂原活化蛋白激酶(MAPK)级联反应的磷酸化显著缺陷,且外施ATP不会增强突变体对于病原菌的抗性,揭示了该通道复合体是eATP信号通路的核心组件。
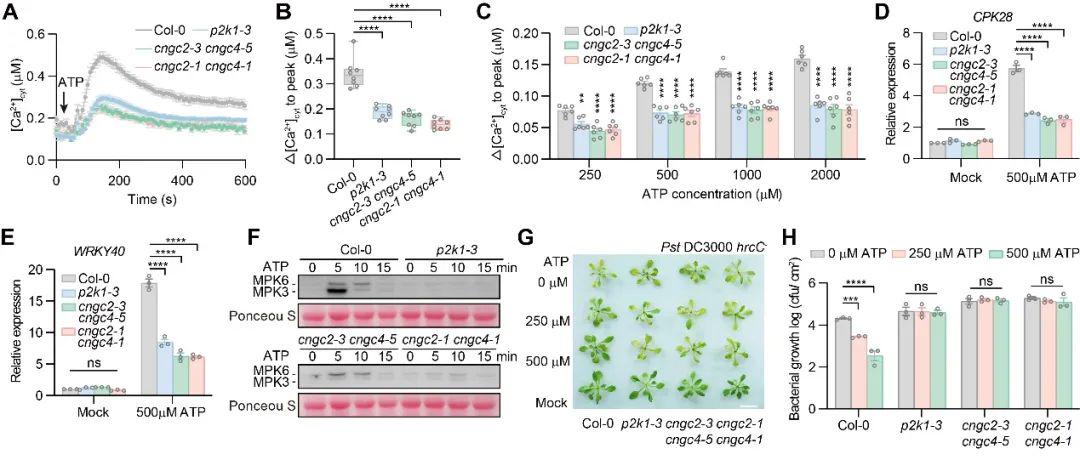
图1. CNGC2-CNGC4通道对ATP诱导的钙反应和免疫应答至关重要
通过双分子荧光互补、免疫共沉淀等实验发现非常谋略,P2K1与CNGC2/4及钙调蛋白CaM7在细胞膜上存在物理互作。结合AlphaFold-Multimer结构预测、双电级电压钳与磷酸化实验表明,P2K1特异性磷酸化CNGC2的S705/S718位点,解除钙调蛋白对通道的抑制,激活CNGC2-CNGC4钙通道复合体。
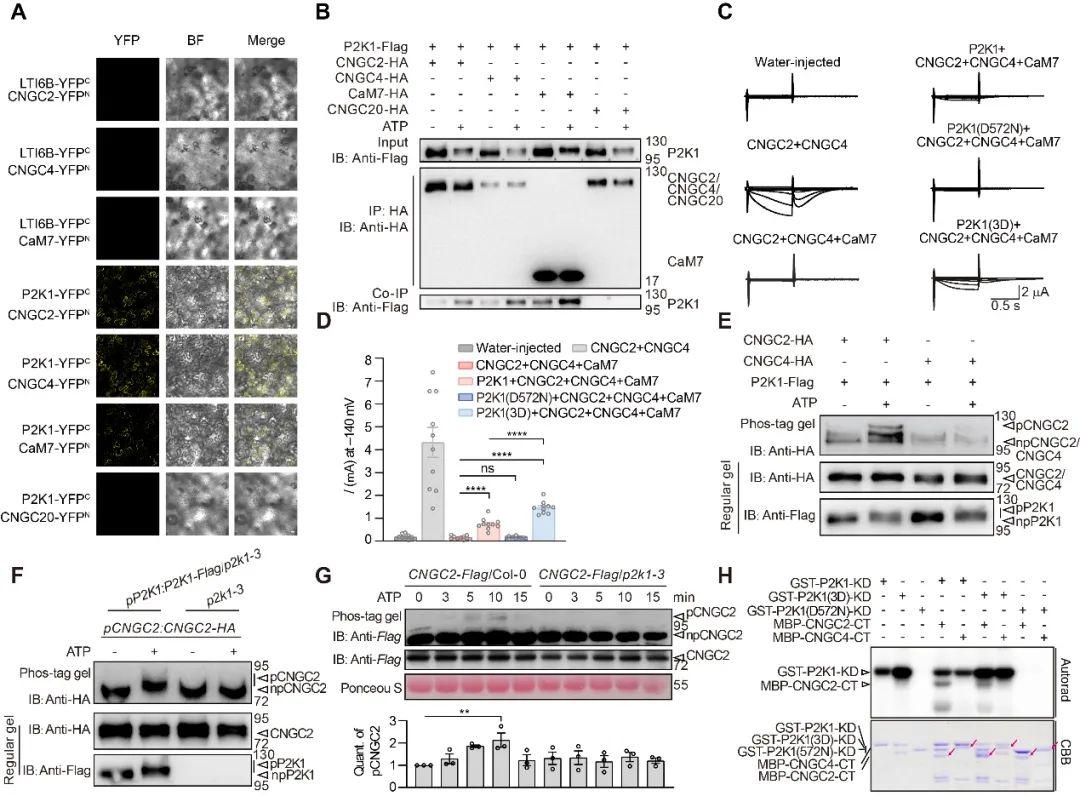
图2. P2K1与CNGC2-CNGC4-CaM7相互作用并磷酸化激活通道
功能验证显示,CNGC2磷酸化位点突变体(S705A/S718A)中,eATP诱导的钙反应、MAPK激活及免疫抗病性缺陷,而模拟磷酸化突变体则恢复功能。值得注意的是,这些位点突变不影响PAMP(flg22)诱导的钙信号,揭示CNGC2-CNGC4通道可以通过“磷酸化密码”区分不同免疫信号:P2K1磷酸化CNGC2响应DAMP(eATP),而BIK1磷酸化CNGC4响应PAMP(flg22)。
基于上述结果,该研究提出:当植物受到病原体攻击时,植物细胞将ATP释放到细胞外。胞外ATP被质膜受体P2K1感知,触发P2K1的自磷酸化激活。激活的P2K1随后磷酸化CNGC2亚基C末端的特定丝氨酸残基S705和S718。这一磷酸化事件解除钙调蛋白(CaM)对CNGC2-CNGC4通道复合体的抑制,激活该钙通道。激活的通道复合体介导Ca2+从胞外快速流入胞质,由此产生的胞质Ca2+浓度升高作为关键的第二信使,启动下游防御反应,包括激活MAPK3/6信号级联和上调免疫相关基因的表达,从而增强植物对病原体的防御能力。
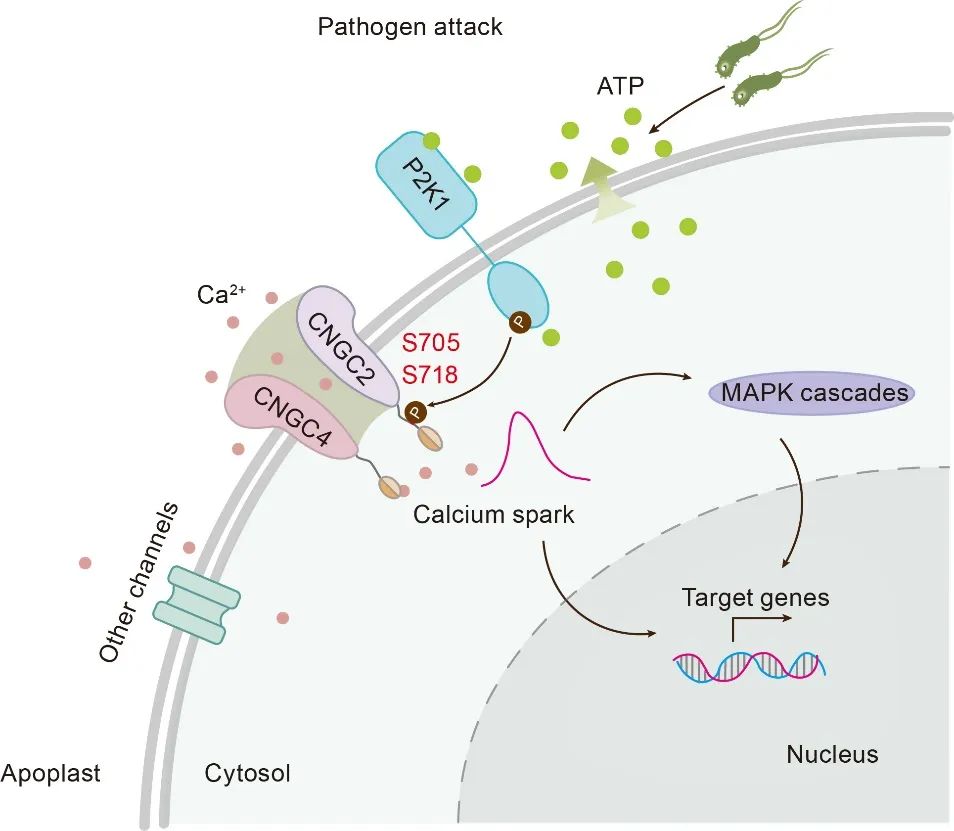
图3. P2K1磷酸化激活CNGC2-CNGC4通道参与eATP介导的免疫反应工作模型
该研究首次建立了从胞外ATP感知到胞内钙信号产生的完整分子链条,填补了ATP作为DAMP启动植物病理反应的重要空白,为理解植物免疫信号的特异性调控机制提供了新视角。该研究团队前期与Sheng Luan教授团队合作,前期工作中揭示了CNGC2和CNGC4组成钙通道在PAMP(flg22)信号通路中的核心作用(Tian et al., 2019)。在此基础上,该研究发现CNGC2-CNGC4钙通道不同磷酸化位点介导不同免疫信号输出,为其通过“磷酸化密码”调控胞内钙信号和下游反应,提供了直接的实验证据。此外,该研究与近期关于拟南芥CNGC1和CNGC5为不受环核苷酸调控的钙离子选择性通道的发现相呼应(Wang et al., 2025),进一步揭示了其不同于动物同源蛋白的激活机制。该研究为解析植物如何精确识别和响应不同病原或胁迫信号提供了新范式,同时加深了人们对植物CNGC通道功能与活性调控多样性的认识。
首都师范大学生命科学学院侯聪聪副教授、李乐攻教授以及加州大学伯克利分校Sheng Luan教授为共同通讯作者,首都师范大学生命科学学院博士生孙钰佳和高磊为共同第一作者。该研究得到了国家自然科学基金重点项目(3193000519)、国家重点研发计划(2021YFA1300700)以及国家自然科学基金面上项目的联合资助。该团队长期致力于细胞离子转运调控及逆境信号编码和解码领域的研究,已取得多项原创性成果。团队研究论文发表于《自然》(Nature)、《细胞研究》(Cell Research)、《自然通讯》(Nature Communications)和《发育细胞》(Developmental Cell)等国际顶尖期刊,团队2022年荣获教育部高等学校科学研究优秀成果奖(科学技术)自然科学奖二等奖。
阳光配资提示:文章来自网络,不代表本站观点。